Nel sangue, sono presenti cellule speciali, classificate in: eritrociti e leucociti. Sono presenti anche le piastrine, che non sono però considerate vere e proprie cellule. Di seguito, verranno descritte le differenti categorie di cellule del sangue.
Nei globuli rossi dei mammiferi, la mancanza del nucleo lascia più spazio all’emoglobina e la forma biconcava aumenta il rapporto tra la superficie e il volume citoplasmatico della cellula. Queste caratteristiche rendono più efficiente la diffusione dell’ossigeno da parte di queste cellule. Nella nota “anemia falciforme”, le emazie assumono una caratteristica forma a falce. Con il microscopio elettronico, si è visto che i globuli rossi possono essere di forme diverse: normali (discociti), a bacca (crenati), a riccio o spinosi (echinociti), codociti, dentellati, a fuso, a falce, a elmetto, appuntiti, indentati, poichilociti, etc. Gli eritrociti hanno una vita media di 120 giorni. Giunti al termine della loro vita, essi vengono trattenuti dalla milza e fagocitati dai macrofagi.
La principale funzione delle piastrine, o trombociti, è di fermare la perdita di sangue nelle ferite (emostasi). A tale scopo, esse si aggregano e liberano fattori che promuovono la coagulazione del sangue. Fra queste c’è la serotonina che riduce il calibro dei vasi lesionati e rallenta il flusso ematico, la fibrina che intrappola cellule e forma il coagulo. Anche se appaiono di forma tondeggiante, le piastrine non sono propriamente delle cellule. Negli strisci colorati con il Giemsa, hanno un colore porpora intenso. Il loro diametro è di circa 2-3 µm, quindi sono assai più piccole degli eritrociti. La loro densità nel sangue è di 200000-300000 /mm3.
I leucociti, o globuli bianchi, sono incaricati della difesa dell’organismo. Nel sangue essi sono assai meno numerosi dei globuli rossi. La densità di leucociti nel sangue è di 5000-7000 /mm3. I leucociti si dividono in due categorie: granulociti e cellule linfoidi (o agranulociti). Il termine di granulociti è dovuto alla presenza di granuli nel citoplasma di queste cellule. Questi granuli sono differenti nei vari tipi di granulocita e ci aiutano a distinguerli. Infatti, questi granuli hanno una differente affinità verso i coloranti neutri, acidi o basici e fanno assumere al citoplasma un colore differente. I granulociti si distinguono dunque in neutrofili, eosinofili (o acidofili), basofili. Le cellule linfoidi, invece, si distinguono in linfociti e monociti. Come vedremo più avanti, anche la forma del nucleo ci aiuta nel riconoscimento dei leucociti.
Ciascun tipo di leucocita è presente nel sangue in proporzioni diverse:
- granulocita neutrofilo 50 – 70 %
- granulocita eosinofilo 2 – 4 %
- granulocita basofilo 0,5 – 1 %
- linfocita 20 – 40 %
- monocita 3 – 8 %
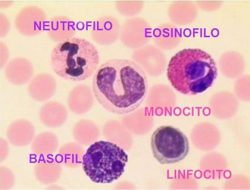
- Gli eosinofili aggrediscono parassiti e fagocitano i complessi antigene-anticorpo.
- I basofili secernono sostanze anticoagulanti, vasodilatatrici come l’istamina e la serotonina. Anche se possiedono capacità fagocitaria, la loro funzione principale è quella di secernere sostanze che mediano la reazione di ipersensibilità.
- I linfociti sono cellule che, oltre a essere presenti del sangue, popolano gli organi e i tessuti linfoidi, nonchè la linfa che circola nei vasi linfatici. Gli organi linfoidi comprendono il timo, il midollo osseo (negli uccelli la bursa), la milza, i linfonodi, le tonsille palatine, le placche di Peyer e il tessuto linfoide dei tratti respiratorio e digerente.
La maggior parte dei linfociti circolanti nel sangue si trova allo stato di riposo. Essi hanno l’aspetto di piccole cellule con nucleo compatto che occupa quasi tutto il volume cellulare. Di conseguenza, il citoplasma è molto ridotto. I linfociti degli organi e dei tessuti linfoidi possono invece essere attivati in varia misura a seguito della stimolazione antigenica. Nel sangue, i linfociti rappresentano il 20-40% di tutti i leucociti e possiedono una dimensione leggermente superiore a quella dei globuli rossi.
I linfociti sono i costituenti principali del sistema immunitario che costituisce una difesa contro l’attacco di microrganismi patogeni quali virus, batteri, funghi e protisti. I linfociti producono anticorpi e li dispongono sulla membrana. Un anticorpo è una molecola proteica in grado di legarsi a una molecola di forma complementare, definita come antigene, e di riconoscerla. Come tutte le proteine, anche gli anticorpi sono codificati da geni. In base ad un meccanismo di ricombinazione di alcuni di questi geni, ogni linfocita produce anticorpi di una forma particolare e che gli è propria. I linfociti esercitano quindi un’azione detta specifica in quanto ciascuno riconosce soltanto l’antigene di forma complementare. Anche se ciascun linfocita è talmente selettivo da riconoscere una sola molecola, il numero di linfociti in circolo è talmente grande che essi possono riconoscere praticamente tutte le sostanze presenti nell’organismo, sia proprie che estranee. Si tratta di un centinaio di milioni di molecole diverse.
Le cellule del sistema immunitario, in particolare i linfociti, cooperano fra loro per attivare, potenziare, precisare la risposta immunitaria. Per raggiungere tale scopo, esistono diversi tipi di linfocita, con funzioni differenti: linfociti T e B. Quando le cellule B vengono attivate, si riproducono intensamente (selezione clonale) e si trasformano in plasmacellule le quali secernono nel circolo una grande quantità di anticorpi (risposta umorale). Questi anticorpi liberi, quando incontrano microrganismi che possiedono molecole di forma complementare (epitopi), si legano ad esse formando dei complessi che li immobilizzano. In seguito, altre cellule non specifiche, ma capaci di riconoscere gli anticorpi, fagocitano questi complessi.
A loro volta, le cellule T si dividono in tre categorie: Tc (citotossici), Th (helpers), Ts (soppressori). Anche i linfociti citotossici si riproducono intensamente quando sono attivati. Tuttavia essi non liberano anticorpi nel circolo, ma li espongono sulla loro membrana e li usano per riconoscere essenzialmente cellule del proprio organismo infettate da virus o tumorali. I linfociti citotossici uccidono le cellule rilasciando perforine, sostanze che producono lesioni sulla membrana della cellula bersaglio e ne provocano la morte per lisi osmotica (risposta cellulo-mediata). I linfociti helper sono necessari per attivare sia i linfociti B che quelli Tc i quali, pur avendo riconosciuto agenti estranei, generalmente non entrano in azione. I linfociti soppressori riducono l’intensità della risposta immunitaria.
Il sistema immunitario non deve però aggredire le cellule dell’organismo a cui appartiene. La reazione autoimmune danneggia l’organismo e può portarlo alla morte. Come fa il sistema immunitario a distinguere fra il sè e il non sè? Abbiamo visto che i linfociti B e quelli Tc che hanno riconosciuto un antigene, non si attivano, ma hanno bisogno dell’attivazione da parte di un linfocita helper. Poco tempo dopo essere stati prodotti, una parte dei nuovi linfociti passa per il timo dove diventano linfociti T. Qui queste cellule vengono confrontate con tutti gli antigeni del proprio corpo (autoantigeni). Sembra che i linfociti Th che riconoscono un antigene, essendo ancora immaturi, vadano incontro a morte. In questo modo, essendo stati soppressi i linfociti Th autoreattivi, possono essere successivamente attivati solo i linfociti B e Tc che abbiano riconosciuto antigeni estranei. Il sistema di citotossicità cellulare mediato dalle cellule Th si è evoluto come una difesa contro le proprie cellule infettate, modificate o aberranti. Infatti, i linfociti Tc e B possono attivarsi contro i batteri anche senza il consenso degli helper.
I linfociti B e Tc attivati, oltre a produrre anticorpi e a uccidere cellule estranee, si moltiplicano attivamente. Durante la divisione cellulare, spesso avvengono dei riarrangiamenti nella sequenza dei geni che codificano per l’anticorpo. In questo modo, l’anticorpo delle nuova cellula assume una forma leggermente differente rispetto a quella del “genitore mitotico”. Se la nuova forma si adatta meglio all’antigene, questa cellula verrà indotta a riprodursi di più. La nuova generazione di cloni è più efficiente della precedente e a sua volta può originare una varietà ancora più selettiva. Questo processo e quello di selezione clonale rendono progressivamente più efficace la risposta immunitaria.
Infine, il sistema immunitario produce cellule memoria, linfociti che si disattivano, ma che sono pronti a riattivarsi in occasione di incontri successivi con lo stesso antigene.
Oltre alle cellule T e B, nel sangue periferico e negli organi linfoidi, si trova una terza popolazione di linfociti che non presenta recettori per l’antigene e che, pertanto, svolge funzioni difensive di tipo non specifico e non è attivata dagli helper. Queste cellule rappresentano la componente filogeneticamente più antica del sistema immunitario e si caratterizzano principalmente per la loro attività citotossica. Per tali ragioni esse vengono denominate cellule NK, Natural Killer. Oltre a uccidere virus, batteri, cellule infettate e cellule neoplastiche, questi linfociti regolano anche la produzione di altre cellule ematiche quali eritrociti e granulociti.
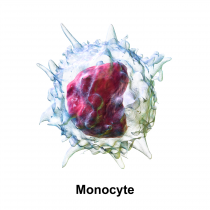
I monociti sono precursori dei macrofagi. Sono le cellule del sangue di dimensione maggiore. Quando nel midollo osseo raggiungono la maturità, vengono immessi nella circolazione sanguigna dove permangono per 24-36 ore. Migrano poi nel tessuto connettivo, dove diventano macrofagi e si muovono nei tessuti. In presenza di un focolaio infiammatorio, i monociti migrano attivamente dai vasi sanguigni e iniziano una intensa attività fagocitaria. Il ruolo di queste cellule non si esaurisce nella fagocitosi poichè mostrano anche un’intensa attività di secrezione. Essi producono sostanze che hanno funzioni difensive, come il lisozima, gli interferoni ed altre sostanze che modulano la funzionalità di altre cellule. I macrofagi cooperano nella difesa immunitaria, espongono sulla membrana molecole dei corpi digeriti e li presentano alle cellule più specializzate, come i linfociti Th e B.